SEVem: Verificación de medicamentos en la oficina de farmacia
A partir del 9 de Febrero de 2019 la farmacia tendrá que autentificar el medicamento en el momento de la dispensación
En 2011, se publicó la Directiva 2011/62/UE del Parlamento europeo y del Consejo de 8 de junio de 2011 que modifica la Directiva 2001/83/CE por la que se establece un código comunitario sobre medicamentos de uso humano, en lo relativo a la prevención de la entrada de medicamentos falsificados en la cadena de suministro legal (en adelante, la Directiva). El objetivo de esta normativa es impedir que los medicamentos falsificados entren en la cadena de suministro.
En febrero de 2016, la Comisión Europea publicó un desarrollo normativo de la Directiva, el Reglamento Delegado (UE) 2016/161 -en adelante, el Reglamento Delegado- que concreta las obligaciones de los fabricantes, mayoristas y farmacéuticos a la hora de garantizar que los medicamentos suministrados a los pacientes sean auténticos.
En España, SEVeM S.L es la entidad jurídica sin ánimo de lucro establecida de acuerdo con lo exigido por el artículo 54 bis de la Directiva 2001/83/CE del Parlamento Europeo y el Consejo, y desarrollado por el Reglamento Delegado (UE) 2016/161 de la Comisión Europea.
Las organizaciones socios fundadores de SEVeM son: la Asociación Nacional Empresarial de la Industria Farmacéutica (FARMAINDUSTRIA), la Asociación Española de Medicamentos Genéricos (AESEG), la Federación de Distribuidores Farmacéuticos (FEDIFAR) y el Consejo General de Colegios Oficiales de Farmacéuticos (CGCOF).
A resultas de esta normativa, todos los fabricantes y titulares de autorización de comercialización (TACs), ya sean laboratorios de innovación, genéricos o importadores paralelos, tendrán que incorporar dos tipos de dispositivos de seguridad en todos los envases de medicamentos sujetos a la obligación de ser verificados.
- El primer dispositivo es un código bidimensional en formato Datamatrix que identifica individualmente el envase.
- El segundo es un dispositivo contra manipulación, que permitirá verificar si el embalaje exterior ha sido objeto de manipulación.Véase el gráfico 1.
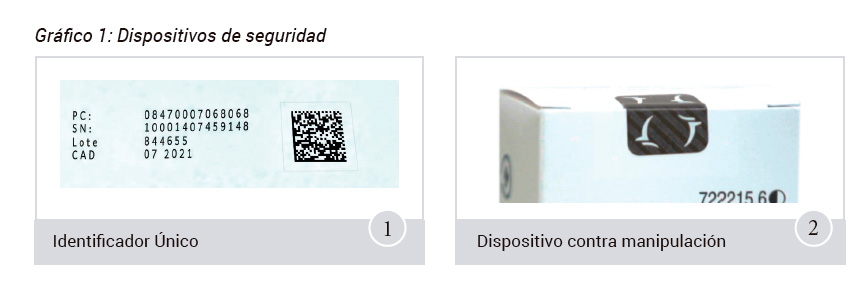
Adicionalmente, la Agencia Española de Medicamentos y Productos Sanitarios participa en las reuniones del Consejo de Administración, para fines
de supervisión del establecimiento y gestión del sistema, de acuerdo a lo previsto en el Reglamento Delegado. A las reuniones de las comisiones técnicas asisten representantes del Ministerio de Sanidad, Consumo y Bienestar Social, así como representantes de la Comisión Permanente de Farmacia del Consejo Interterritorial del Sistema Nacional de Salud (CISNS).
Los fabricantes y titulares de autorización de comercialización introducirán estos identificadores únicos para todos los envases sujetos a la obligación de verificación, que se vayan a comercializar en la Unión Europea y Espacio Económico Europeo, en una base de datos central, también denominado “Plataforma europea”.
Dicha plataforma conectará con los sistemas nacionales, asegurando la interoperabilidad entre ellos. Los códigos de los medicamentos serializados se descargarán en el mercado de destino, por ejemplo, en España se transferirán a SEVeM, el Sistema Español de Verificación de Medicamentos.
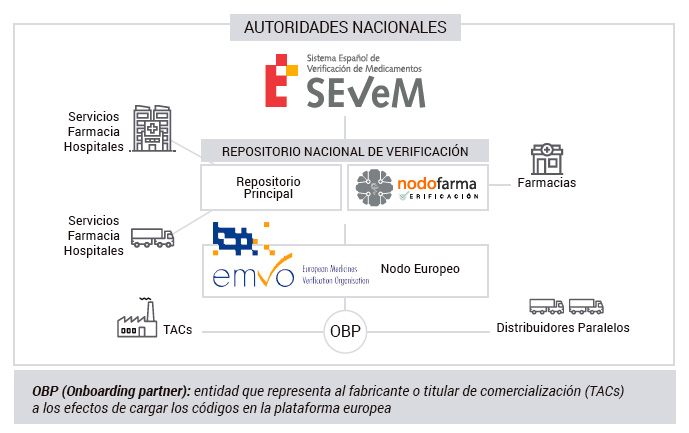
En su circuito a través de la cadena del medicamento, el envase será verificado y/o autenticado. Los distribuidores solo verificarán en los casos previstos en la normativa europea y nacional, en base a un análisis de riesgo.

Descarga la información completa en la documentación pinchando aquí.